論文:大腸憩室炎予防のための低フォドマップ食
論文:大腸憩室炎予防のための低フォドマップ食
Logical hypothesis: Low FODMAP diet to prevent diverticulitis.
World J Gastrointest Pharmacol Ther. 2016 Nov 6;7(4):503-512
Yoshiharu Uno1, Jennifer C. van Velkinburgh2
Institution: 1) Office Uno Column, Japan
2) Filipodia
Publishing, USA
<著者による和訳>
論文要旨
憩室炎のための高繊維食の治療効果についての証拠はほとんどないが、それは一般に臨床管理の一部として推奨されている。
憩室炎が悪化する原因について不明であることは、この療法の有効性を検証することを混乱させている。 しかし、結腸憩室炎の予防に対する高繊維食は論理的に明確に矛盾している。
腸管が拡張すると直径が増加し、流体速度を低下するベルヌーイの定理を憩室の原因に適応させた場合、理論的には結腸内の高圧の予防が重要であり、低FODMAP食(発酵性、オリゴ糖、二糖類、単糖類およびポリオールからなる)は憩室炎の再発を予防するのに役立つ可能性がある。
キーワード:憩室疾患、高繊維食、低FODMAP食、ベルヌーイの定理、過敏性腸症候群
イントロダクション
大腸憩室炎が食事と関連するという考えは、1969年にPainterによって最初に展開された。[1] 彼は憩室疾患が、精製された小麦粉と砂糖と低残食を食べる人々で発生したことを報告し、その後、再び1970年、彼はアフリカには憩室疾患がなかったと述べた。[2] Painterは、著名な英国の外科医であるDenis Parsons Burkittと観察の個人的な通信によってアフリカで口から肛門までの通過時間が短いことを説明し、食物繊維ついて提唱した。この情報は、低残摂取に関連していることを理論化しようとしていたPainterを刺激し、ゆっくりと大腸を通過して粘性便につながる「文明化の食事」は文明国における憩室疾患の高い発生率を説明できると記した。そして、Painterは憩室疾患のリスクを軽減するために文明国の伝統的な低残渣食ではなく、全粒パン、未処理のふすま、お粥や果物からなるそのような高い残留物の摂取量を得られる食事を推奨した。
1971年に、PainterとBurkittは大腸憩室症について「繊維仮説」を共同で発表し、十分な繊維を持つ未精製の天然食品をベースにした食事が憩室疾患を予防する可能性があることを示唆した。[3] その後の研究では、より高い繊維食の摂取量によって腸管内の容量が増加することによって、大腸内の内圧の上昇を防止し、腸管通過時間を短くさせ、粘性の低い便を生じると報告された。[4-6] そして、繊維食の支持者は、高食物繊維は大腸の過度の収縮を抑制し、大腸の内腔を広げるために役立つだろうと示唆した。これらの知見は、憩室疾患が便秘と強く関連しているという理論につながった。[7] しかし、この繊維仮説には明らかな矛盾がある。まず、便の量と消化管通過時間との関係は反比例ではなく、指数関数の一部の関係にすぎない。[4] そのため、300グラム以上の便では消化管通過時間を短くすることは不可能である。したがって、その有効性の範囲が制限される。また、メタンガスの増加は、憩室症の存在にリンクされている。[8] 食物繊維に含まれているセルロースは、メタンガス生成菌により発酵させることができる[9]。 2016年に、カプセルを用いた研究では、高繊維食は大腸における低繊維食よりも多くのガスを生成した。[10] すなわち、理論的には、過剰な食物繊維の摂取が腸内で糞やガスを蓄積することにより、状態を悪化させる可能性がある。根底にある憩室の発生機序は不明であるにもかかわらず、繊維の仮説は広く、適切な介入として採用されてきた。実際、過去45年間で、繊維仮説自体は、憩室疾患の食事指導のための基礎となっている。アメリカ消化器病学会(AGA)によって公開されている最新の患者ガイドでは、少なくとも毎日25グラムの繊維の摂取を推奨している。[11] しかし、いくつかの最近の研究からの知見は、そのような高繊維仮説の妥当性に疑問を投げかけている。[12-16] Peery らによる研究では、低繊維食と憩室疾患との間に関連性は見出されなかった。[17] その研究は、30歳から80歳の間の2104人(憩室疾患878例および憩室疾患のない1226例)が対照であったが、その結果、総繊維摂取量が高い場合に 複数の憩室の有病率の増加を認めた。多発性憩室の発生との有意な関連を示した特定の繊維の種類は、穀粒、不溶性繊維、および可溶性繊維であった。 1年後の同グループの別の研究では、低食物繊維食で下行結腸またはS状結腸の憩室症の危険性が増加しなかったことが判明し、食物繊維摂取と便通頻度の低下や便秘の症状、憩室症との関連は認められなかった。[18] Braunschmidらによるその後の研究では結腸憩室疾患が便秘症状と相関しないことを見出した。[19]
大腸憩室の病態生理
大腸筋層と大腸憩室の関係:理論的には、粘膜ヘルニア(粘膜が外へ脱出)の形成のためには、管腔内に高い圧力と関係する筋肉層における既存の欠陥(弱体化)が必要である。通常、人間の大腸の筋層は、内輪筋と縦走筋で構成され、後者は盲腸からS状結腸の先端部まで連続する3つの結腸紐として位置している。[20] S状結腸内の憩室炎の手術標本を電子顕微鏡で調べた研究では、結腸紐は対照のものと比較して200%以上のエラスチン[膠原繊維]を認めた。憩室炎の罹患結腸組織の領域における増加したエラスチンは、増加していない組織の隣接する領域に比べて不平等な弾力性と強度を引き起こす可能性がある。[21]さらに、炎症や感染の存在する状態は結腸組織を肥厚させる原因となり、弾力性に影響を与え、引張強さの減少につながる。
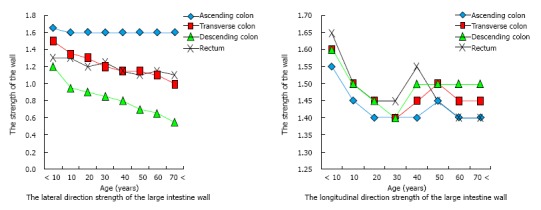
最後に、結腸憩室症の有病率は年齢と相関しているため、加齢によって大腸壁が脆弱することによって生じる [22]。興味深いことに、ヨーロッパ、アジアとアフリカの両方の集団の研究では、S状結腸強度は年齢で減少するという同様の調査結果を示している。[23] 日本人の研究では年齢とともに大腸(横方向)の強度が減少する。(図1)[24]
図1. 大腸壁の老化に伴う強さの変化。
下行結腸(横方向)は、老化に関連する強度の低下を示す。 対照的に、上行結腸は、加齢に関連する強度の低下を示さない。
大腸内視鏡検査中に内側からの圧力の影響の結腸引き裂きの調査では、S状結腸壁は最初の固有筋層破裂し、漿膜および粘膜の順で引き裂かれる。[25] このように、生理的条件下では、筋層が結腸の壁に最も弱い層であると思われる。したがって、遠位結腸の構造的完全性に影響を与える要因を考慮した場合、この部位における憩室の発生は、年齢とともに増加する腸壁の脆弱性に関連し得ると仮定することができる。
対照的に、上行結腸では加齢に伴う強度の減少を示していない。(図1)すなわち、右側結腸は、加齢によって左側結腸よりも影響を受けにくい。しかし、硬い便は通常、近位結腸には存在しないため、この領域では、便による閉じた空間を形成しない。つまり、理論的には、近位結腸での憩室の形成には自然な脆弱性の存在を必要とする。全ての動物は大腸の結腸紐があるのではなく、結腸紐があるのはげっ歯類の中で、霊長類、ウマおよびモルモットとウサギの中で、人間とサルである。[26] 憩室疾患の自然発生はサルや馬で報告されているが、結腸紐のある小動物では実験的に憩室を作成することができる。 [27-30] 結腸紐を有する動物における憩室のこれらの特徴は、結腸紐と大腸憩室の間の因果関係を示唆する証拠である。
大腸憩室は最も頻繁に結腸紐の側面に沿って発生する。[31] その理由は、これらの部位は貫通血管が交差している大腸の筋肉に最も弱い点に発生すると推測されている。[7] [32-35] 大腸憩室の形成が完了するまで、内から外へ押し出すは圧力の継続的な力によって憩室が生じることが理論化される。しかし、この仮説はまだ実験的証明されていない。しかし、さらに、この理論によって、大腸憩室は低血管系の横行結腸の自由ひもと大網ひもの間に発生しないと考えられている。
しかし、1925のLinebackの論文で、結腸紐の両側に欠陥があることが記されている。[36] 輪状筋と縦走筋と接触している部位では収束を形成し、円形の筋肉の束間の裂け目を生じるが、この部位は憩室の最も頻度が高い部位に一致する。(図2)
図2. 大腸筋層の裂け目
さらに、輪状筋および縦走筋が連結される部位であるため、これらの裂け目は、筋肉の収縮に伴って広がることがある。
この理論は、同じサイズの複数の憩室が同時に存在するという事実と矛盾しない。 さらに、これらの裂け目には血管が含まれており[36]、出生時以降から存在する可能性がある。
この理論は、この部位におけるガスの影響が小さいため、横行結腸の下方には憩室が生じないことについても矛盾しない。
憩室炎後の管腔内圧力:これまで、ラプラスの法則(壁張力=半径×圧力)に応じて、高繊維食によって生成される糞便が結腸の直径を増大し、ひいては管腔内の圧力が減少されると考えられてきた。[35] [37] これは、Painterの「セグメンテーション仮説」の理論に基づいている。Painterは次のように記載した:結腸の両端が閉塞し、密閉空間が「小さな膀胱」の連続として作用する[1][7]。しかし、大腸は膀胱と異なっている:大腸は肛門までの完全閉塞のない連続空間である。加えて、この理論は、可能かつ有効であるためにラプラスの法則を適応させるためには結腸壁が十分に柔軟でなければならない。腸の適切な収縮を有する患者では、高繊維食は効果的な予防または介入措置であってもよいかもしれない。しかし、硬度のある、または過度の収縮のある腸壁を有する患者では、腸管が高い腔内圧力と腸壁に作用する必然的な増加の力につながり、高繊維食に応じて適切に伸展されることはない。炎症の影響を受け肥厚した大腸では、壁や炎症後線維症の兆候を示す。[38] 憩室炎の患者で、結腸内圧を用いたin vivo試験では腸管の運動は下行結腸およびS状結腸で増加し、直腸では増加を示さなかった。[39] [40] 別の研究では、S状結腸憩室で患者の症状を評価するために、CTコロノグラフィ(大腸内視鏡検査)を使用したが、腹痛は空気圧と関連していた。[41] これらのデータを考慮すると、高繊維食によって生じる糞便量の増加は、憩室炎の再発を防ぐために期待できない。それだけではなく、理論的に、高繊維食によって憩室炎の症状を促進し、再発のリスクをもたらす可能性がある。
流体及び気体のダイナミクス:小さな硬い便は、単独では結腸内の高圧状態を引き起こすことができない。複数の硬い便が腸管腔に蓄積することができるが、それらは排他的圧力の影響を説明することはできない。ガスがなく、便が時間をかけて蓄積された場合、腸管はゆっくりと拡張される。理論的には、腸壁影響するのに十分な圧力上昇を得るために急速に大腸内を移動する物質が必要である。そのような物質は、管腔内の気体または液体である。1964年、Painterは、腸管内の内部圧力を生成するために、流体(バリウム)を使用し、閉じたS状結腸で圧力>50 mmHg到達したことを示した。[7] [42] さらに、閉塞空間で圧力レベルが>90 mmHgに達することを理論化した。高い力(特に56~80 mmHg)は、3フィート(91センチメートル)の高さからバリウム注腸投与を使用して他の研究によって確認され、これらの圧力は、安全と考えられていた。[43] しかし、6フィート(1.8メートル)の高さから投与した場合、140から168 mmHgに達し管腔内結腸圧力が安全の閾値を上回ると、穿孔を引き起こす可能性ある。[43] これまで、空気圧による腸管穿孔は、多くの研究の課題であった。[44-49] 内視鏡の安全空気圧の上限は80 mmHgである。[50]. Braykoらは漿膜および粘膜における高圧穿孔の特性を研究し、(202 mmHgで226 mmHgのそれぞれ)破裂のために必要な圧力は、通常の内視鏡検査で憩室の穿孔のリスクが低いとした。 [51] 別の研究では、しかしながら、CTコロノグラフィ(38〜40 mmHgで)の低圧力が腹痛を誘導することができた。[41] したがって、人間の結腸は≥40mmHgでの空気の圧力によって痛みを感じ、穿孔の危険性が≥80mmHgで起こる。憩室は80mmHg以下の圧力筋肉層の割れ目に誘導することができる一方で、200 mmHg以上なければ粘膜および漿膜は穿孔しない。そして、腹痛のない無症候性として存在する憩室のほとんどのケースでは、新たな憩室の完成に必要な圧力は40 mmHg以下である可能性があると考察される。
腸内の圧力は、液体だけでなく、空気の流体力学に影響される。圧縮ガスは、ボイルの法則によれば、圧縮されていない液体よりも高いエネルギーを有す。したがって、液体の存在は、腸のように限られた空間内の空気の圧力を増加させる。バリウムコを用いた研究では、大腸憩室のない対照群と比較して大腸憩室の患者では近位のS状結腸内通過時間が倍の速度を示したが、胃腸排出の合計時間は両群で同様だった。[52] これらの結果は、内腔の直径が大きい場合、圧力が増加され、流体速度が減少することを示すベルヌーイの定理によって説明することができる。(図3)
図3.
Bernoulliの定理によれば、拡張された場所での圧力が増加する。
この法則を考慮すると、直腸の狭窄では、S状結腸の内部の圧力が増加すると予想され、下行結腸が収縮されたときに、近位結腸の圧力を増加する。結腸の括約筋は7カ所存在する。[53] ベルヌーイの定理は、各(膨起を含む)収縮及び括約筋の部位に適合させることができる。(図4)
図4. 右および左の憩室疾患の背景と症状における差異。
右結腸の幅は左結腸の幅の約2倍である[53]。 大腸はS1を含む7つの括約筋[53]を含む:Busiリング; S2:Hirshリング; S3:キャノンリング。 S4:Payr-Strausリング。 S5:ボールリング; S6:Moultierリング。 S7:ロッシーリング。 青色の領域は、サイトの頻度を表す。 白人では、憩室疾患(DD)が最も頻繁に左側および中年後に発生する。
アジア人では、DDは幼児期と右側で最も頻繁に発生する。 右憩室は出血しやすいが、穿孔、膿瘍形成、瘻孔形成、または構造化の重篤な憩室関連合併症を発症する可能性は低い[7,54]。
右結腸憩室と左結腸憩室の頻度の差の原因については、各部位の圧力の違いによって説明することができる。日本では、近位結腸における大腸憩室症の発生率が高い。[55] また、日本の憩室症が、特に右側に影響を与える条件での研究では、上行結腸の高い管腔内圧力(>20 mmHgの)と異常な運動性が確認されている。[55] 別の研究グループが、シンチグラフィーによりガス圧の流体運動を調べたところ、注射後60分に観察によって、空腸に注入されたガスが盲腸と右結腸に残り、移動しないことを発見した。そして、直腸に注入されたガスは、直腸S状結腸に残った。[56] つまり、ガスが発酵された部位の位置は、その部位で圧力の影響をうける。以上から、結腸における過剰な圧力は、ガスと水の両方の管腔内濃度に関連することが理解できるが、では、次に、結腸におけるガスや水分のレベルの上昇は何によるか?を考える。
食物繊維は、大腸内のガスを増加させる。[10] [57] 野菜や果物に含まれる主要な食物繊維はイヌリンであり、その摂取量が鼓腸につながる。[58] この論文の冒頭に引用した2015 年のAGAのガイドラインでは、食物繊維が(レンズ豆など)豆類、ヨーグルトの摂取、新鮮なフルーツを介して取得することが薦められている。[11]しかし、ヨーグルト、豆はオリゴ糖を含むため発酵によって、腸内ガスを発生する。[59]
[60] 果糖不耐症を持つ個人の場合には、新鮮な果物を食べることは腹痛、げっぷ、膨満感、膨満感、消化不良の不快感、下痢、になることがある。[61]従って、AGAによって推奨されている食事成分は、実質的に多量の腸内ガス量を生産する。
憩室炎のための代替食事療法
最近、過敏性腸症候群のための食事療法に基づく治療の開発に関心がもたれ、低発酵性、オリゴ糖、二糖類、単糖類からなる食事、およびポリオール(FODMAP)は有望な候補として挙げられる。 FODMAPsは、消化や小腸に吸収されない。[62] [63]したがって、それらの摂取が原因で、高浸透圧による回腸内の流体が増加し、加えて、それらは大腸内の発酵によって産生される大量のガスを導く。
過敏性腸症候群を有する患者は低FODMAP食の採用によって、症状の有意な改善を示している。[64] [65]
高FODMAP食の腸管の有害な影響は、回腸内の流体含有量を増加させるためであり[67]、これはラクツロース飲用後のMRI研究によって実証されている。[66]この研究では、間接的に水素呼気検査によってラクツロース誘発性のガスの増加を測定したが、FODMAP食のより最近の研究では、腹部X線によって増加する腸内ガスの直接の確認を得た[68]。これらの知見は、FODMAP食はガスや流体の管腔内容積を増加させるという理論を支持している。呼気テストは確かに有用な試験ではあることは言うまでもない。Jangらは、10gのラクツロース摂の180分後に右の結腸憩室患者の呼気テストを行い、対照と比較してメタンガスは増加したが、水素ガスは減少したと判断した。[69] しかし、この研究で180分を超える時点、具体的には摂取後240〜300分の時点で、ラクツロース摂取に応答してガス容積が有意に増加するか確認する必要がある [68]。したがって、より正確な臨床症状の結腸ガスの影響を調査するために、研究デザインは、発酵が大腸に発生するのに十分な時間を可能にすることが必要である。
低FODMAP食は乳糖を含む食品の回避を主張している。乳糖は浸透圧によって回腸で水分が増加し、腸の水分含量の増加を引き起こすだけでなく、容易に、短鎖脂肪酸の産生ガスを導く結腸の微生物叢によって発酵される:主に水素(H 2)、二酸化炭素(CO2)、メタン(CH4)。[70] そのため、乳糖不耐症を持つ個人は、食事摂取の結果として下痢や腹部膨満を体験することができる。乳糖不耐症の有病率は、白人集団に低く、アジアとアフリカの高い。では、次に、右結腸憩室症と乳糖不耐症の間の潜在的な相関関係を説明する。公的に利用可能な文献[71-87]で右結腸の憩室症と乳糖不耐症の報告と10カ国の中では、非常に強い相関(図5、R2=0.9562)を示した。(表1)
表1.右結腸の憩室疾患と乳糖不耐症の割合
、
図5.乳糖不耐性と右憩室疾患との関係。 Au:オーストラリア
乳糖不耐症の発生率は、米国で最も低く、右側結腸憩室症の発生率も最も低い。しかし、アジア諸国は、右側結腸憩室症と乳糖不耐症の両方の高い発生率を示している。これらの知見により、乳糖不耐症によって右側結腸憩室症が生じると仮説をたてることができる。日本では、若年者のDDはほとんど排他的に結腸の右側に関係する。 (図6)[77]
図6. 憩室疾患の発症時の部位と年齢との関係
そして、日本においても左の結腸憩室のリスクは、年齢と共に増加することが見出された。29歳未満の成人では、憩室症の症例の100%が右側に関与している。
日本では、7-15歳の小児の憩室症はまれではない。これらの小児憩室症の症例は、盲腸および上行結腸で発生する。[85,86] この知見は、加齢に関連した筋層の脆弱性だけでは説明できず、小児期に関連する要因を示す可能性がある。日本人の子供の86%が6歳までに乳糖不耐症を発症することが報告されている(3歳児で30%、4歳児で36%、5歳児で58%)。[76 ] 乳糖摂取後に腸内でガスが増加するのに要する時間は、1〜2時間であり、これは高FODMAP食の他の成分のいずれかに必要な時間よりも短い。したがって、乳糖摂取は、日本の子供、特に乳糖不耐性の子供の右結腸に多量の気体および液体を誘発する可能性がある。増加したガスおよび液体によってもたらされる物理的圧力は、粘膜に影響を及ぼし、おそらく出生時に存在する生理学的な裂け目の中にそれを押し出す。これは、なぜ若い日本人の憩室が右側だけに発生するのかを説明するかもしれない。一方、多くのヨーロッパ人およびアメリカの白人は、左大腸の憩室症の発症が多い。
この現象は、歴史的にアジアの社会と比較して小麦粉の摂取量が多いことに関連している可能性がある。[90] 小麦粉のフルクタン成分は、高FODMAPの一部である。 腸内でのフルクタンの発酵に要する時間は2〜6時間と比較的長く[91,92]、高い圧力が左結腸で起こる。 しかし、日本では、第二次世界大戦以来、小麦粉の摂取量が増加しており、このような食生活パターンは、欧米の食生活に近い形に変化する。
例えば、日本では憩室症は1960年代に2%と報告されたが[93]、1980年代には20%に増加した。[94] また、日本でも左結腸憩室症例が年々増加している。[94-97] この傾向は、韓国人で報告された傾向に類似している。[79] 食生活の変化に加えて、近年の日本人の寿命の延長は、観察された左側憩室症の上昇にも寄与している可能性がある。 さらに、日本では過敏性腸症候群の罹患率が著しく増加している。過敏性腸症候群の罹患率は、1996年のローマIでは3.6%[98]、2006年は10.7%(ローマII)[99]、2010年は14.0%(ローマIII)であった。[
100] したがって、大腸憩室症と過敏性腸症候群は互いに相関するだけでなく、食事の病因成分を共有することも理由と考えられる。
過敏性腸症候群と大腸憩室症の間の潜在的な相関関係についていくつかの報告がなされている。[54,101-103] 過敏性腸症候群と一致する症状は、大腸憩室症の患者の間では一般的であり、この症候は非憩室症の対照と比較して大腸憩室症の患者において有意に高いと報告されている。[103-105] しかしながら、この症状の重複は、憩室炎を過敏性腸症候群として誤断する可能性がある。[104] 過敏性腸症候群および憩室炎は異なる症状であり、憩室炎は顕著な特徴として炎症の特徴を示す。 したがって、憩室炎の患者に過敏性腸症候群の診断基準を適合させることは不適切である可能性がある。
しかし、両者は、消化管内の内圧に起因すると推定される腹痛を伴う腹部膨満の一般的症状を共有する。 いずれにせよ、症状の原因が結腸内の過剰量の気体および液体成分である場合、いずれかまたは両方の減少は、憩室症の慢性症状を予防するのに役立つ可能性がある。過敏性腸症候群は機能障害として分類され、憩室炎は器質的疾患として分類される。
両者の最も顕著な違いは、憩室炎群の間で炎症および/または炎症後の恒常性狭窄症を有する症例を含むことである。 形の変化は炎症の結果であるが、原因は同じかもしれない。憩室炎患者は憩室のない過敏性腸症候群よりも重度の症状を持続する。 Cuomoら[105]は、これらの症状の違いにより憩室炎患者と過敏性腸症候群の患者とを区別できる可能性があると示唆した。
しかし、彼らの研究デザインは、発熱を伴い入院と治療を必要とする患者集団に基づいているため、炎症のない憩室症例は考慮されていなかった。さらに、憩室炎に関連する炎症が過剰な収縮をもたらし、過敏性腸症候群の症状を誘発する可能性がある。[106] 両方の条件において、ベルヌーイの定理は、任意の様々な要因によって引き起こされる腸管内の不均一な圧力の生成に関与しえる。
また、狭窄のない無症候性憩室症患者では、FODMAPが高い高繊維食は過敏性腸症候群を誘発する可能性もある。 このような食事では、イヌリンとオリゴ糖は摂取後6〜48時間で発酵により短鎖脂肪酸とガスを生成し、糞便のpHは7〜6に低下する。[107,108]
過敏性腸症候群の患者は、健常対照と比較して、結腸内管腔内pHが低下していることが実証されている。[109,110] より低いpHは、より高い結腸発酵を示唆する。 具体的には、重症度スコアおよび腹痛の評価が含まれた無線運動性カプセル(SmartPill)の研究では、過敏性腸症候群の患者が結腸(pH7.3の健常対照と比較して)で6.8のpHを有し、結腸低pHレベルが過敏性腸症候群の症状と相関していることを示した。さらに、過敏性腸症候群は、下行結腸からS状結腸の過剰な収縮を特徴としていた。[111] 興味深いことに、別の研究では、過敏性腸症候群の患者の盲腸の低pHでは右結腸収縮の減少と相関していた[112]。 これらの所見は、過敏性腸症候群がベルヌーイの定理に従う可能性が高いことを示しており、また、憩室症の病因にもベルヌーイの定理が適応できる可能性が高いことを示している。
結論
大腸憩室炎に対する高繊維仮説は論理的矛盾を表している。 高繊維食は、憩室炎の長期管理には適していない可能性が高い。大腸の筋層に存在する解剖学的な裂け目から、ベルヌーイの原理に基づいて、ガスおよび流体に関連する力の圧力によって粘膜が脱出することが憩室を発症させる理由である。
しかしながら、右結腸憩室はまた、乳糖不耐性に関連する可能性がある。 高FODMAPを有する高繊維の現在推奨されている食事は、結腸内に相当量のガス発生をもたらし、過敏性腸症候群の症状と関連する低pHをもたらす可能性がある。 理論的には、低FODMAP食は、再発性憩室炎の予防に有効である。
References
1. Painter NS.
Diverticulosis of the colon and diet. Br Med J. 1969;2:764–765.
2. Painter NS. Pressures
in the colon related to diverticular disease. Proc R Soc Med. 1970;63
Suppl:144–145.
3. Painter NS, Burkitt DP.
Diverticular disease of the colon: a deficiency disease of Western
civilization. Br Med J. 1971;2:450–454.
4. Burkitt DP, Walker AR,
Painter NS. Effect of dietary fibre on stools and the transit-times, and its
role in the causation of disease. Lancet. 1972;2:1408–1412. 5. Spiller
GA, Chernoff MC, Shipley EA, Beigler MA, Briggs GM. Can fecal weight be used to
establish a recommended intake of dietary fiber (plantix) Am J Clin
Nutr. 1977;30:659–661.
6. Saito T, Hayakawa T,
Nakamura K, Takita T, Suzuki K, Innami S. Fecal output, gastrointestinal
transit time, frequency of evacuation and apparent excretion rate of dietary
fiber in young men given diets containing different levels of dietary
fiber. J Nutr Sci Vitaminol (Tokyo) 1991;37:493–508.
7. Painter NS. USA:
William Heinemann Medical Books Ltd; 1975. Diverticular disease of the colon: A
deficiency disease of western civilization.
8. Yazici C, Arslan DC,
Abraham R, Cushing K, Keshavarzian A, Mutlu EA. Breath Methane Levels Are
Increased Among Patients with Diverticulosis. Dig Dis
Sci. 2016;61:2648–2654.
9. Robert C,
Bernalier-Donadille A. The cellulolytic microflora of the human colon: evidence
of microcrystalline cellulose-degrading bacteria in methane-excreting
subjects. FEMS Microbiol Ecol. 2003;46:81–89.
10. Kalantar-Zadeh K, Yao
CK, Berean KJ, Ha N, Ou JZ, Ward SA, Pillai N, Hill J, Cottrell JJ, Dunshea FR,
et al. Intestinal Gas Capsules: A Proof-of-Concept Demonstration. Gastroenterology. 2016;150:37–39.
11. American
Gastroenterological Association. A Patient Guide: Managing
Diverticulitis. Gastroenterology. 2015;149:1977–1978.
12. Tan KY, Seow-Choen F.
Fiber and colorectal diseases: separating fact from fiction. World J
Gastroenterol. 2007;13:4161–4167.
13. Ünlü C, Daniels L,
Vrouenraets BC, Boermeester MA. A systematic review of high-fibre dietary
therapy in diverticular disease. Int J Colorectal
Dis. 2012;27:419–427. 14. Peery AF, Sandler RS. Diverticular
disease: reconsidering conventional wisdom. Clin Gastroenterol
Hepatol. 2013;11:1532–1537.
15. Tursi A, Papa A,
Danese S. Review article: the pathophysiology and medical management of
diverticulosis and diverticular disease of the colon. Aliment Pharmacol
Ther. 2015;42:664–684.
16. Elisei W, Tursi A.
Recent advances in the treatment of colonic diverticular disease and prevention
of acute diverticulitis. Ann Gastroenterol. 2016;29:24–32.
17. Peery AF, Barrett PR,
Park D, Rogers AJ, Galanko JA, Martin CF, Sandler RS. A high-fiber diet does
not protect against asymptomatic
diverticulosis. Gastroenterology. 2012;142:266–272.
18. Peery AF, Sandler RS,
Ahnen DJ, Galanko JA, Holm AN, Shaukat A, Mott LA, Barry EL, Fried DA, Baron
JA. Constipation and a low-fiber diet are not associated with
diverticulosis. Clin Gastroenterol Hepatol. 2013;11:1622–1627.
19. Braunschmid T, Stift
A, Mittlböck M, Lord A, Weiser FA, Riss S. Constipation is not associated with
diverticular disease - Analysis of 976 patients. Int J
Surg. 2015;19:42–45.
20. Meyers MA, Volberg F,
Katzen B, Abbott G. Haustral anatomy and pathology: a new look. I. Roentgen
identification of normal patterns and
relationships. Radiology. 1973;108:497–504.
21. Whiteway J, Morson BC.
Elastosis in diverticular disease of the sigmoid
colon. Gut. 1985;26:258–266.
22. Almerie MQ, Simpson J.
Diagnosing and treating diverticular disease. Practitioner. 2015;259:29–33.
23. Watters DA, Smith AN,
Eastwood MA, Anderson KC, Elton RA, Mugerwa JW. Mechanical properties of the
colon: comparison of the features of the African and European colon in
vitro. Gut. 1985;26:384–392.
24. Iwasaki T. Study on
the strength of human intestinal walls. J Kyoto Prefectural Univ
Med. 1953;52:673–702.
25. Uno Y, Morita T.
Colonic perforation and serosal tears associated with
colonoscopy. Lancet. 1997;349:1888.
26. Stevens CE, Hume ID.
Contributions of microbes in vertebrate gastrointestinal tract to production
and conservation of nutrients. Physiol Rev. 1998;78:393–427.
27. Hodgson J. Animal
models in the study of diverticular disease. Part I: aetiology and
treatment. Clin Gastroenterol. 1975;4:201–219.
28. Hare WC. Observations
On A Case Of A Diverticulum In The Small Colon Of The Horse. Can J Comp
Med Vet Sci. 1959;23:272–273.
29. Bunton TE, Bacmeister
CX. Diverticulosis and colonic leiomyosarcoma in an aged rhesus
macaque. Vet Pathol. 1989;26:351–352.
30. Hayama SI, Rika
Akamatsu R, Kishimoto M, Suzuki M, Hideo Nigi H. A case of diverticular disease
of the colon in a Japanese monkey (Macaca fuscata) Primates. 1988:29:
423–426.
31. Meyers MA, Volberg F,
Katzen B, Abbott G. Haustral anatomy and pathology: a new look. II. Roentgen
interpretation of pathological
alterations. Radiology. 1973;108:505–512.
32. Griffiths JD.
Extramural and intramural blood-supply of colon. Br Med
J. 1961;1:323–326.
33. Slack WW. The anatomy,
pathology, and some clinical features of divericulitis of the colon. Br J
Surg. 1962;50:185–190. 34. Hughes LE. Postmortem survey of
diverticular disease of the colon. I. Diverticulosis and
diverticulitis. Gut. 1969;10:336–344.
35. Maykel JA, Opelka FG.
Colonic diverticulosis and diverticular hemorrhage. Clin Colon Rectal
Surg. 2004;17:195–204.
36. Lineback PE. Studies
on the musculature of the human colon, with special reference to the
taeniae. Am J Anat. 1925;36:357–383.
37. Sheth AA, Longo W,
Floch MH. Diverticular disease and diverticulitis. Am J
Gastroenterol. 2008;103:1550–1556.
38. Fenoglio-Preiser CM,
Lantz PL, Listrom MB, Davis M, Rike FO. New York: Raven Press; 1989.
Gastrointestinal pathology: An atlas and text; pp. 632–634.
39. Bassotti G, Battaglia
E, Spinozzi F, Pelli MA, Tonini M. Twenty-four hour recordings of colonic
motility in patients with diverticular disease: evidence for abnormal motility
and propulsive activity. Dis Colon Rectum. 2001;44:1814–1820.
40. Viebig RG, Pontes JF,
Michelsohn NH. Electromanometry of the rectosigmoid in colonic
diverticulosis. Arq Gastroenterol. 1994;31:135–144.
41. Sosna J, Bar-Ziv J,
Libson E, Eligulashvili M, Blachar A. CT colonography: positioning order and
intracolonic pressure. AJR Am J Roentgenol. 2008;191:1100.
42. Painter NS. The
aetiology of diverticulosis of the colon with special reference to the action
of certain drugs on the behaviour of the colon. Ann R Coll Surg
Engl. 1964;34:98–119.
43. Noveroske RJ.
Intracolonic pressures during barium enema examination. Am J Roentgenol
Radium Ther Nucl Med. 1964;91:852–863.
44. Wojtalik RS,
Lindenauer SM, Kahn SS. Perforation of the colon associated with adynamic
ileus. Am J Surg. 1973;125:601–606.
45. Kozarek RA, Earnest
DL, Silverstein ME, Smith RG. Air-pressure-induced colon injury during
diagnostic colonoscopy. Gastroenterology. 1980;78:7–14.
46. Sandhu KS, Cohen H.
Cecal perforation following fiberoptic flexible sigmoidoscopy. Am J
Med. 1987;82:546–548.
47. Luchette FA, Doerr RJ,
Kelly K, Kulaylat M, Stephan RM, Hassett JM. Colonoscopic impaction in left
colon strictures resulting in right colon pneumatic perforation. Surg
Endosc. 1992;6:273–276.
48. Foliente RL, Chang AC,
Youssef AI, Ford LJ, Condon SC, Chen YK. Endoscopic cecal perforation:
mechanisms of injury. Am J Gastroenterol. 1996;91:705–708.
49. Tzelepis GE, Nasiff L,
McCool FD, Hammond J. Transmission of pressure within the abdomen. J Appl
Physiol (1985) 1996;81:1111–1114.
50. Woltjen JA. A
retrospective analysis of cecal barotrauma caused by colonoscope air flow and
pressure. Gastrointest Endosc. 2005;61:37–45.
51. Brayko CM, Kozarek RA,
Sanowski RA, Howells T. Diverticular rupture during colonoscopy. Fact or
fancy? Dig Dis Sci. 1984;29:427–431.
52. Leandro PA, Cecconello
I, Habr-Gama A, de Olivereira e Silva A, Pontes JF. Gastrointestinal motility
in normal subjects and patients with diverticulosis of the colon. Arq
Gastroenterol. 1984;21:157–163.
53. Reeders JW, Rodenbush
G. New York: Thieme Medical Publishers, Inc; 1994. Clinical radiology and
endoscopy of the colon.
54. Spiller R. Editorial:
new thoughts on the association between diverticulosis and irritable bowel
syndrome. Am J Gastroenterol. 2014;109:1906–1908.
55. Sugihara K, Muto T,
Morioka Y. Motility study in right sided diverticular disease of the
colon. Gut. 1983;24:1130–1134.
56. Harder H, Serra J,
Azpiroz F, Passos MC, Aguadé S, Malagelada JR. Intestinal gas distribution
determines abdominal symptoms. Gut. 2003;52:1708–1713.
57. Marthinsen D, Fleming
SE. Excretion of breath and flatus gases by humans consuming high-fiber
diets. J Nutr. 1982;112:1133–1143.
58. Muir JG, Shepherd SJ,
Rosella O, Rose R, Barrett JS, Gibson PR. Fructan and free fructose content of
common Australian vegetables and fruit. J Agric Food Chem. 2007;55:6619–6627.
59. Suarez FL, Springfield
J, Furne JK, Lohrmann TT, Kerr PS, Levitt MD. Gas production in human ingesting
a soybean flour derived from beans naturally low in oligosaccharides. Am J
Clin Nutr. 1999;69:135–139.
60. Cummings JH,
Macfarlane GT, Englyst HN. Prebiotic digestion and fermentation. Am J Clin
Nutr. 2001;73:415S–420S.
61. Choi YK, Kraft N,
Zimmerman B, Jackson M, Rao SS. Fructose intolerance in IBS and utility of
fructose-restricted diet. J Clin
Gastroenterol. 2008;42:233–238.
62. Gibson PR, Shepherd
SJ. Personal view: food for thought--western lifestyle and susceptibility to
Crohn’s disease. The FODMAP hypothesis. Aliment Pharmacol
Ther. 2005;21:1399–1409.
63. Gibson PR, Shepherd
SJ. Food choice as a key management strategy for functional gastrointestinal
symptoms. Am J Gastroenterol. 2012;107:657–666; quiz 667.
64. Halmos EP, Power VA,
Shepherd SJ, Gibson PR, Muir JG. A diet low in FODMAPs reduces symptoms of
irritable bowel syndrome. Gastroenterology. 2014;146:67–75.e5.
65. Chumpitazi BP, Cope
JL, Hollister EB, Tsai CM, McMeans AR, Luna RA, Versalovic J, Shulman RJ.
Randomised clinical trial: gut microbiome biomarkers are associated with
clinical response to a low FODMAP diet in children with the irritable bowel
syndrome. Aliment Pharmacol Ther. 2015;42:418–427.
66. Clausen MR, Jørgensen
J, Mortensen PB. Comparison of diarrhea induced by ingestion of
fructooligosaccharide Idolax and disaccharide lactulose: role of osmolarity
versus fermentation of malabsorbed carbohydrate. Dig Dis
Sci. 1998;43:2696–2707.
67. Undseth R, Berstad A,
Kløw NE, Arnljot K, Moi KS, Valeur J. Abnormal accumulation of intestinal fluid
following ingestion of an unabsorbable carbohydrate in patients with irritable
bowel syndrome: an MRI study. Neurogastroenterol
Motil. 2014;26:1686–1693.
68. Uno Y. Pilot Study on
Gas Patterns of Irritable Bowel Syndrome and Small Intestinal Bacterial
Overgrowth Following Ingestion of Lactulose. Open J
Gastroenterol. 2015;5:155–163.
69. Jang SI, Kim JH, Youn
YH, Park H, Lee SI, Conklin JL. Relationship between intestinal gas and the
development of right colonic diverticula. J Neurogastroenterol
Motil. 2010;16:418–423.
70. Deng Y, Misselwitz B,
Dai N, Fox M. Lactose Intolerance in Adults: Biological Mechanism and Dietary
Management. Nutrients. 2015;7:8020–8035.
71. Bolin TD, Davis AE,
Seah CS, Chua KL, Yong V, Kho KM, Siak CL, Jacob E. Lactose intolerance in
Singapore. Gastroenterology. 1970;59:76–84.
72. Wong SK, Ho YH, Leong
AP, Seow-Choen F. Clinical behavior of complicated right-sided and left-sided
diverticulosis. Dis Colon Rectum. 1997;40:344–348.
73. Silanikove N, Leitner
G, Merin U. The Interrelationships between Lactose Intolerance and the Modern
Dairy Industry: Global Perspectives in Evolutional and Historical
Backgrounds. Nutrients. 2015;7:7312–7331.
74. Rungjiratananon S,
Sirinthornpunya S. Prevalence of colonic diverticulosis in irritable bowel
syndrome patients compared to other patients in Rajavithi hospital prevalence
of colonic diverticulosis. Thai J Gastroenterol. 2009;10:148–151.
75. Chan CC, Lo KK, Chung
EC, Lo SS, Hon TY. Colonic diverticulosis in Hong Kong: distribution pattern
and clinical significance. Clin Radiol. 1998;53:842–844.
76. Nose O, Iida Y, Kai H,
Harada T, Ogawa M, Yabuuchi H. Breath hydrogen test for detecting lactose
malabsorption in infants and children. Prevalence of lactose malabsorption in
Japanese children and adults. Arch Dis Child. 1979;54:436–440.
77. Kubo A, Ishiwata J,
Maeda Y, Kida T, Yamabe K, Shimosegawa T. Clinical studies on diverticular
disease of the colon. Jpn J Med. 1983;22:185–189.
78. Park SH, Chang YW, Kim
SJ, Lee MH, Nam JH, Oh CH, Kim JW, Jang JY, Yang JO, Yoo JA, et al. [Efficacy
of Lactose-free Milk in Korean Adults with Lactose Intolerance] Korean J
Gastroenterol. 2016;67:22–27.
79. Oh HK, Han EC, Ha HK,
Choe EK, Moon SH, Ryoo SB, Jeong SY, Park KJ. Surgical management of colonic
diverticular disease: discrepancy between right- and left-sided
diseases. World J Gastroenterol. 2014;20:10115–10120.
80. Pawłowska K, Umławska
W, Iwańczak B. Prevalence of Lactose Malabsorption and Lactose Intolerance in
Pediatric Patients with Selected Gastrointestinal Diseases. Adv Clin Exp
Med. 2015;24:863–871.
81. Blachut K, Paradowski
L, Garcarek J. Prevalence and distribution of the colonic diverticulosis.
Review of 417 cases from Lower Silesia in Poland. Rom J
Gastroenterol. 2004;13:281–285.
82. Goenka MK, Nagi B,
Kochhar R, Bhasin DK, Singh A, Mehta SK. Colonic diverticulosis in India: the
changing scene. Indian J Gastroenterol. 1994;13:86–88. [PubMed]
83. Smith GD, Lawlor DA,
Timpson NJ, Baban J, Kiessling M, Day IN, Ebrahim S. Lactase
persistence-related genetic variant: population substructure and health
outcomes. Eur J Hum Genet. 2009;17:357–367.
84. Golder M, Ster IC,
Babu P, Sharma A, Bayat M, Farah A. Demographic determinants of risk, colon
distribution and density scores of diverticular disease. World J
Gastroenterol. 2011;17:1009–1017.
85. Yoshimoto K, Terakura
H, Hiki S, Ogata H. Diverticulitis in children. Stomach and Intestine
(Tokyo) 2012;47:1135–1140.
86. Watanuki H, Minota N,
Takahara M, et al. Study on diverticulitis of the large intestine in
children. J Jpn Red Cross Himeji Hosp. 2015;39:71–74.
87. Mummah S, Oelrich B,
Hope J, Vu Q, Gardner CD. Effect of raw milk on lactose intolerance: a
randomized controlled pilot study. Ann Fam Med. 2014;12:134–141.
88. Yang JF, Fox M, Chu H,
Zheng X, Long YQ, Pohl D, Fried M, Dai N. Four-sample lactose hydrogen breath
test for diagnosis of lactose malabsorption in irritable bowel syndrome
patients with diarrhea. World J
Gastroenterol. 2015;21:7563–7570.
89. Schommer K, Reljic D,
Bärtsch P, Sauer P. Gastrointestinal complaints in runners are not due to small
intestinal bacterial overgrowth. J Negat Results Biomed. 2011;10:8.
90. De Giorgio R, Volta U,
Gibson PR. Sensitivity to wheat, gluten and FODMAPs in IBS: facts or
fiction? Gut. 2016;65:169–178.
91. Murray K,
Wilkinson-Smith V, Hoad C, Costigan C, Cox E, Lam C, Marciani L, Gowland P,
Spiller RC. Differential effects of FODMAPs (fermentable oligo-, di-,
mono-saccharides and polyols) on small and large intestinal contents in healthy
subjects shown by MRI. Am J Gastroenterol. 2014;109:110–119.
92. Fedewa A, Rao SS.
Dietary fructose intolerance, fructan intolerance and FODMAPs. Curr
Gastroenterol Rep. 2014;16:370.
93. Inoue M. The
epidemiologic and clinical features of diverticular disease of the
colon. J Jpn Soc Coloproctol. 1992;45:904–913.
94. Miura S, Kodaira S,
Aoki H, Hosoda Y. Bilateral type diverticular disease of the colon. Int J
Colorectal Dis. 1996;11:71–75.
95. Takano M, Yamada K,
Sato K. An analysis of the development of colonic diverticulosis in the
Japanese. Dis Colon Rectum. 2005;48:2111–2116.
96. Yamada E, Inamori M,
Uchida E, Tanida E, Izumi M, Takeshita K, Fujii T, Komatsu K, Hamanaka J, Maeda
S, et al. Association between the location of diverticular disease and the
irritable bowel syndrome: a multicenter study in Japan. Am J
Gastroenterol. 2014;109:1900–1905.
97. Tarao K, Sekino Y,
Nonaka T, Iida H, Inamori M, Nakajima A, Maeda S, Natsumeda Y, Ikegami T,
Ohshige K. Recent trends in colonic diverticulosis in Yokohama City: a
possibility of changing to a more Western profile. Intern Med. 2015;54:2545–2550.
98. Itasaka T, Takahashi
T. Epidemiological study of irritable bowel syndrome using population
screening. Ther Res. 1996;17:4059–4063.
99. Shiotani A, Miyanishi
T, Takahashi T. Sex differences in irritable bowel syndrome in Japanese
university students. J Gastroenterol. 2006;41:562–568.
100. Miwa H. Life style in
persons with functional gastrointestinal disorders--large-scale internet survey
of lifestyle in Japan. Neurogastroenterol Motil. 2012;24:464–471,
e217.
101. Annibale B, Lahner E,
Maconi G, Usai P, Marchi S, Bassotti G, Barbara G, Cuomo R. Clinical features
of symptomatic uncomplicated diverticular disease: a multicenter Italian
survey. Int J Colorectal Dis. 2012;27:1151–1159.
102. Sirinthornpunya S,
Rungjiratananon S. Association of colonic diverticular disease and irritable
bowel syndrome in Thai patients. J Med Assoc Thai. 2014;97 Suppl
11:S18–S24.
103. Jung HK, Choung RS,
Locke GR, Schleck CD, Zinsmeister AR, Talley NJ. Diarrhea-predominant irritable
bowel syndrome is associated with diverticular disease: a population-based
study. Am J Gastroenterol. 2010;105:652–661.
104. Longstreth GF, Tieu
RS. Clinically Diagnosed Acute Diverticulitis in Outpatients: Misdiagnosis in
Patients with Irritable Bowel Syndrome. Dig Dis
Sci. 2016;61:578–588.
105. Cuomo R, Barbara G,
Andreozzi P, Bassotti G, Casetti T, Grassini M, Ierardi E, Maconi G, Marchi S,
Sarnelli G, et al. Symptom patterns can distinguish diverticular disease from
irritable bowel syndrome. Eur J Clin Invest. 2013;43:1147–1155.
106. Cohen E, Fuller G,
Bolus R, Modi R, Vu M, Shahedi K, Shah R, Atia M, Kurzbard N, Sheen V, et al.
Increased risk for irritable bowel syndrome after acute
diverticulitis. Clin Gastroenterol Hepatol. 2013;11:1614–1619.
107. Kaur A, Rose DJ,
Rumpagaporn P, Patterson JA, Hamaker BR. In vitro batch fecal fermentation
comparison of gas and short-chain fatty acid production using “slowly
fermentable” dietary fibers. J Food Sci. 2011;76:H137–H142.
108. Noack J, Timm D,
Hospattankar A, Slavin J. Fermentation profiles of wheat dextrin, inulin and
partially hydrolyzed guar gum using an in vitro digestion pretreatment and in
vitro batch fermentation system
model. Nutrients. 2013;5:1500–1510.
109. Choi CH, Ringel-Kulka
T, Temas DJ, Kim A, Scott K, Ringel Y. Altered colonic bacterial fermentation
is a steadfast pathophysiological factor in irritable bowel
syndrome. Gastroenterology. 2014;146:S8.
110. Ringel-Kulka T, Choi
CH, Temas D, Kim A, Maier DM, Scott K, Galanko JA, Ringel Y. Altered Colonic
Bacterial Fermentation as a Potential Pathophysiological Factor in Irritable
Bowel Syndrome. Am J Gastroenterol. 2015;110:1339–1346.
111. Clemens CH, Samsom M,
Van Berge Henegouwen GP, Smout AJ. Abnormalities of left colonic motility in
ambulant nonconstipated patients with irritable bowel syndrome. Dig Dis
Sci. 2003;48:74–82.
112. Farmer AD, Mohammed
SD, Dukes GE, Scott SM, Hobson AR. Caecal pH is a biomarker of excessive
colonic fermentation. World J Gastroenterol. 2014;20:5000–5007.






コメント
コメントを投稿